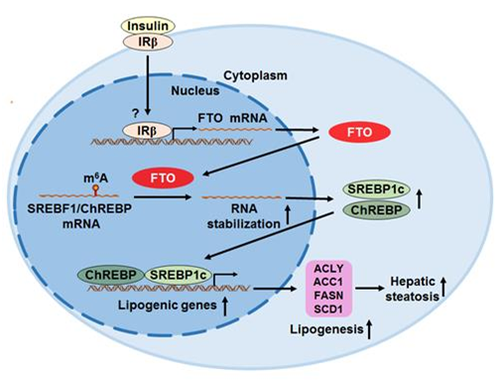
2022年11月10日,中国科学院上海营养与健康研究所应浩研究团队在学术期刊Journal of Molecular Cell Biology正式发表了题为“Aberrant elevation of FTO levels promotes liver steatosis by decreasing the m6A methylation and increasing the stability of SREBF1 and ChREBP mRNAs”的研究论文。该研究发现了脂肪量和肥胖相关(fat mass and obesity-associated,FTO)基因在胰岛素调节的肝脏脂肪生成和非酒精性脂肪肝病(NAFLD)发病过程中的关键机制。肝脏FTO能去甲基化并稳定关键脂肪生成转录因子(SREBF1和ChREBP)的mRNA,从而上调负责肝脏脂肪生成的关键脂肪生成酶的表达水平,导致出现肝脏脂肪变性。此外,胰岛素可诱导肝脏FTO的表达,FTO介导胰岛素的部分脂肪生成作用。最后,抑制FTO可以减少肝脏脂肪生成和甘油三酯(TG)积累,暗示FTO可以作为治疗NAFLD的潜在靶点。
NAFLD已成为最常见的慢性肝病,发病率高于2型糖尿病和肥胖症。它也是全球肝脏相关死亡率中增长最快的因素,目前还没有FDA批准的药物。NAFLD的标志是肝TG积累。一系列研究表明,增加TG产生(脂肪酸摄取和DNL)而不是减少动员(脂肪酸氧化和VLDL输出)是NAFLD发展的主要机制,其中DNL可能是NAFLD发病的重要驱动因素。许多DNL酶,如ACLY、ACC1、FASN和SCD1,受SREBP1c和ChREBP蛋白的协调调节。
N6-甲基腺苷(m6A)是最丰富的表观遗传修饰,至少分布在四分之一的哺乳动物mRNA中,在各种生理病理过程中调控mRNA代谢。m6A修饰是由一组名为甲基转移酶(Writer)和去甲基酶(Eraser)的酶动态控制的。m6A修饰可以被甲基阅读蛋白(Reader)识别。FTO是通过全基因组关联研究(GWAS)鉴定的肥胖易感基因,有研究发现啮齿动物和NAFLD患者的脂肪肝中FTO表达水平增加。尽管知道FTO参与调节肝脏脂肪生成,但FTO在肝脏脂肪生成中的生理病理作用尚不完全清楚。
该研究发现,小鼠非酒精性脂肪肝中,总RNA m6A甲基化减少,并伴随着FTO表达的增加。肝脏过表达FTO在体内和体外均能促进脂肪变性。在肝细胞中,FTO过表达能特异性地上调负责脂肪生成的基因,但不影响参与脂肪酸摄取/氧化或脂蛋白输出的基因。从机制上讲,FTO可以通过m6A去甲基化来稳定SREBF1和ChREBP的mRNA,从而导致其蛋白质水平增加。胰岛素治疗在体内和体外均可增加FTO表达。抑制FTO的去甲基化酶活性可以降低SREBF1、ChREBP以及脂肪生成基因的表达,从而改善小鼠脂肪肝中TG的积累。该研究发现了“胰岛素/FTO/SREBP1c/ChREBP/脂肪生成”信号通路,巩固了FTO是NAFLD重要贡献者的结论。FTO通过去甲基酶活性,在肝脏脂肪代谢中增加了一层动态的基因表达调控机制。靶向肝脏FTO作为治疗NAFLD的策略,在未来值得进一步探讨。
中国科学院上海营养与健康研究所博士研究生唐志立为该论文的第一作者,应浩研究员、博士研究生李卓阳和复旦大学附属医院中山医院蒋晶晶博士为本文的通讯作者。该研究得到了科技部及基金委项目的支持,同时也得到中国科学院上海营养与健康研究所公共技术平台和动物平台的支持。
图注FTO信号通路示意图
注:胰岛素刺激肝细胞后,FTO的表达增加。FTO可以通过m6A去甲基化来稳定SREBF1和ChREBP的mRNA,从而导致其蛋白质水平增加,最终促进了肝脏脂肪生成,导致肝脏脂肪变性。