6月19日,《科学》杂志封面报道了来自上海药物所抗疫攻关团队的一项重要研究——中国科学院上海药物研究所柳红/许叶春/蒋华良团队联合上海科技大学杨海涛/饶子和团队和中国科学院武汉病毒所张磊砢/肖庚富团队通力合作,在抗新型冠状病毒药物研究中取得重要进展,发现一类结构新颖、高效、安全的抗SARS-CoV-2病毒候选药物。
图片来源:Illustration: C. Bickel/Science; Data: PDB ID 6M0K (SARS-CoV-2 main protease)
本研究最初于3月28日发表在生物预印本网站bioRxiv上,并于4月22日在《科学》在线发表。
截止目前,由新型冠状病毒(SARS-CoV-2)感染引起的肺炎(COVID-19)全球确诊病例超过250万,感染死亡人数增至17万,已发展为全球性的大流行病,且目前尚无特效的抗病毒药物和疫苗用于COVID-19的治疗。
SARS-CoV-2属于单正链的RNA病毒,和SARS-CoV以及MERS-CoV具有较高的同源性。
该病毒感染进入宿主细胞后,在宿主细胞的帮助下,其遗传物质RNA首先翻译表达出两条多聚蛋白前体(pp1a和pp1ab),多聚蛋白前体在3CL蛋白酶和木瓜样蛋白酶的作用下发生分子内的切割产生多个非结构蛋白,由于3CL蛋白酶至少负责11个位点的切割,故又称之为主蛋白酶(main protease,M???)。
多聚蛋白前体产生的非结构蛋白参与了病毒亚基因RNA和四个结构蛋白(E蛋白、M蛋白、S蛋白和N蛋白)的产生,进而完成子代病毒的繁衍与释放。
由于主蛋白酶在病毒的生命周期中起到了至关重要的作用,且人体内没有同源蛋白,故主蛋白酶是一个抗病毒药物研发的理想靶点。
柳红/蒋华良团队多年来从事抗病毒药物研发并积累了丰富的经验。
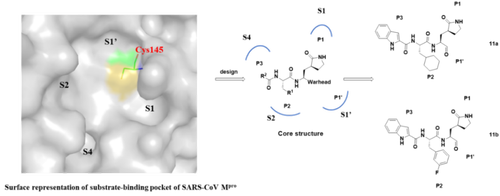
基于冠状病毒主蛋白酶三维结构,该团队设计并合成了两个拟肽类化合物11a和11b。
这两个化合物在体外展示出对SARS-CoV-2 M???极佳的抑制活性 (11a: IC?? = 0.053 ± 0.005 μM,11b: IC?? = 0.040 ± 0.002 μM),同时抗病毒活性测试结果表明,化合物11a和11b都具有较好的抗病毒效果,EC??分别为0.53 μM和0.72 μM。
更为重要的是这两个化合物均展示出良好的体内药代动力学性质和安全性,有开发成为抗SARS-CoV-2新药的潜力。
SARS-CoV-2主蛋白酶抑制剂的设计策略及化合物11a和11b的化学结构
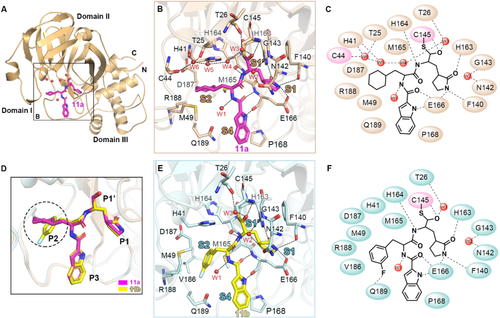
化合物11a和11b与SARS-CoV-2主蛋白酶复合物的三维结构显示这两个化合物均占据底物结合口袋,其中化合物的醛基和蛋白酶催化位点145位半胱氨酸残基形成共价键,牢牢地将其锁住。高分辨的复合物结构信息不仅展示了化合物11a和11b与主蛋白酶精确的互作模式,还揭示了化合物抑制病毒蛋白酶的分子机制。
化合物11a和11b与SARS-CoV-2主蛋白酶晶体复合物及结合模型
中科院上海药物研究所柳红研究员、上海科技大学杨海涛教授、中科院武汉病毒所张磊砢副研究员和中科院上海药物研究所许叶春研究员为本文的共同通讯作者。
其中,柳红/许叶春/蒋华良团队完成化合物的设计、合成和酶水平抑制活性评价, 张磊砢/肖庚富团队完成细胞水平抗病毒的活性评估,杨海涛/饶子和团队完成化合物与靶蛋白复合物晶体结构的解析工作。该研究还得到国家成都新药安全性评价中心的大力支持。
中科院上海药物所与中国药科大学联合培养博士生戴文豪、上海科技大学免疫化学研究所副研究员张兵博士、武汉病毒所硕士研究生姜夏铭和中科院上海药物所博士生苏海霞为本文的共同第一作者。
该项研究得到了国家科学技术部、国家自然科学基金委员会、中国工程院-马云基金会、上海科学技术委员会、广西壮族自治区科技厅以及前沿生物药业(南京)股份有限公司的资助。
新冠疫情爆发以来,中科院上海药物所抗疫攻关团队积极承担药物研发领域应急攻关任务。团队开展工作5个月以来,在新冠肺炎治疗药物应急研发中取得了重要进展,在新药研发、老药筛选、病毒结构解析等领域取得了系列成果,在疫情防控中发挥了科技支撑作用。
(信息来源:中国科学院上海药物研究所)