中国科学院上海有机化学研究所生物与化学交叉研究中心朱正江研究员团队与浙江省肿瘤医院朱骥教授团队在Nature Communications杂志在线发表了题为“Serum Metabolic Traits Reveal Therapeutic Toxicities and Responses of Neoadjuvant Chemoradiotherapy in Patients with Rectal Cancer”的研究论文(Nature Communications,2022,13:7802)。该工作通过对接受新辅助放化疗(Neoadjuvant Chemoradiotherapy,nCRT)的直肠癌患者放化疗过程中多个时间点的血清代谢组学分析,揭示了放化疗治疗过程中的代谢特征变化,并发现了一系列与放化疗毒性和疗效相关的代谢特征和功能代谢物。
朱正江课题组博士研究生王洪淼和上海交通大学医学院的贾慧珣博士是论文的共同第一作者,中国科学院上海有机化学研究所生物与化学交叉研究中心为第一单位。
结直肠癌是世界范围内第三高发的消化道恶性肿瘤,大约15%的结直肠癌患者在就诊时被诊断为局部晚期直肠癌,这一部分患者往往伴随着较高的术后复发风险和转移风险。当前,新辅助放化疗逐渐成为局部晚期直肠癌的标准疗法。但是,放化疗的疗效在患者间存在明显的个体异质性,仅有部分患者在治疗后可以实现病理完全缓解(pCR)。在前期研究中,朱骥医生团队开展了一项多中心随机化的三期临床研究(CliClare,J.Clin.Oncol.2020,38:4231-4239)。该临床研究表明在传统的卡培他滨放化疗方案的基础上,通过添加UGT1A1基因型指导用量的伊利替康用药方案可以将患者的病理完全缓解(pCR)比例从10%提高至35%。但是,在放化疗过程中由于药物毒性等因素的影响,患者可能发生包括腹泻、白血球减少、嗜中性粒细胞减少等多种不良反应。这些不良反应不利于患者的后续治疗,极大地限制了新辅助放化疗疗法的临床应用。
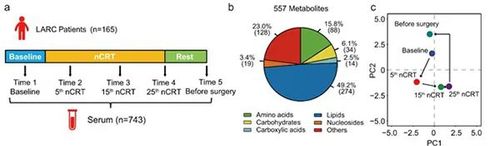
图1实验设计示意图,利用非靶向代谢组学鉴定到的代谢物种类和数目,以及在放化疗过程中代谢组变化的主成分分析得分图(图片来源:Nature Communications)
为了探究直肠癌病人与放化疗相关的代谢特征,作者利用朱正江课题组发展的大规模非靶向代谢组学精准测量分析技术系统表征了来自165个直肠癌病人在新辅助放化疗过程中五个时间点共743个血清样本的代谢组,并利用课题组自主研发的MetDNA软件精准鉴定了557个小分子代谢物,描绘了病人放化疗过程中的代谢变化图谱。研究发现放化疗会引起血清代谢组的整体变化,包括色氨酸在内的多种相关代谢物在放化疗后显著下调。进一步的,本研究对放化疗引发的腹泻等不良反应进行研究,构建了在治疗前预测腹泻风险和血细胞计数最低点的代谢物预测模型。该预测模型可以在进行放化疗前对患者发生不良反应的风险进行评估,从而对患者实现精准诊疗以避免放化疗引起的不良反应。本研究还表明,相较于男性,女性患者在治疗过程中具有拥有更高的腹泻发生风险,而乙酰肉碱类代谢物与这种性别异质性存在紧密联系。
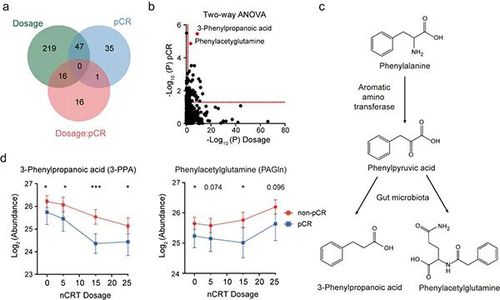
图2 3-苯丙酸(3-phenylpropanoic acid)和苯乙酰谷氨酰胺(phenylacetylglutamine)在放化疗过程中与新辅助放化疗的疗效相关(图片来源:Nature Communications)
作者还对患者放化疗治疗之后的病理完全缓解疗效差异进行了代谢组学研究。通过对于放化疗剂量和疗效相关的代谢物进行双因素筛选,本研究并发现两种肠道菌群的衍生代谢物,3-苯丙酸(3-phenylpropanoic acid)和苯乙酰谷氨酰胺(phenylacetylglutamine)与新辅助放化疗的疗效密切相关。在整个放化疗过程中,实现病理完全缓解的患者血清中这两种代谢物均保持着较低的水平。这意味着血清中较低的3-苯丙酸和苯乙酰谷氨酰胺可能有助于放化疗中肿瘤的退缩,预示着肠道菌群可能在放化疗治疗中起到重要的调控作用。此外,在经过放化疗治疗后,相比于未发生病理完全缓解的患者,病理完全缓解的患者具有更高的必需氨基酸的水平,而在放化疗之前两组患者并无差异。这表明血清必需氨基酸水平可以反映新辅助放化疗的疗效,这可能预示着患者在治疗过程中的营养水平与疗效存在紧密关联。本研究对新辅助放化疗过程中的血清代谢组学变化进行了多层次的系统性研究,揭示了新辅助放化疗过程中的动态代谢变化,并为个体化的新辅助放化疗提供了代谢层面的潜在指导方案。
该工作得到了国家自然科学基金委、科技部、中国科学院、上海市科委等基金项目的资助。