奥拉帕尼是首个获批上市的PARP抑制剂,已成功应用于卵巢癌、乳腺癌、胰腺癌及前列腺癌的治疗。然而,肿瘤患者不可避免地对其产生耐药性,迄今尚无能够克服奥拉帕尼耐药的新药进入临床试验。
中国科学院上海药物研究所缪泽鸿、丁健、陈奕课题组联合上海交通大学药学院张翱课题组和中国科学院上海营养与健康研究所郎靖瑜课题组,通过PARP1酶活性抑制和PARP1-DNA结合能力变化的联合筛选模式,成功获得具有克服奥拉帕尼耐药潜力的新一代强效PARP抑制剂噻奥哌瑞(thioparib)(图1)。
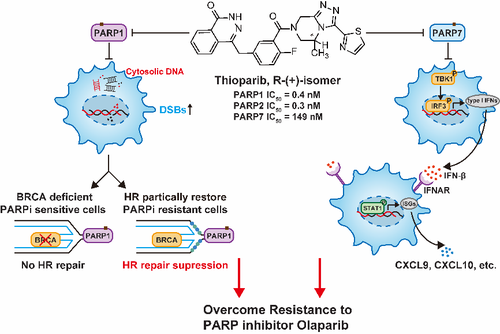
图1噻奥哌瑞的结构和作用机制原理示意图。
相关成果以“Thioparib inhibits homologous recombination repair,activates the type I IFN response,and overcomes olaparib resistance”为题近日发表在国际学术期刊EMBO Molecular Medicine上。
噻奥哌瑞体外抑制PARP1酶活性的IC50为0.4 nM、促进PARP1-DNA结合的EC50为25 nM,分别强于奥拉帕尼2.5倍和24倍。噻奥哌瑞同时抑制PARP2、PARP7等PARP家族成员。除诱导经典的PARP1依赖的DNA损伤蓄积、细胞周期阻滞与细胞凋亡外,噻奥哌瑞还以PARP1部分依赖的途径抑制同源重组(Homologous recombination,HR)修复功能和抑制PARP7-TBK1/IRF3通路激活I型干扰素信号通路,产生抗耐药和抗肿瘤免疫作用。
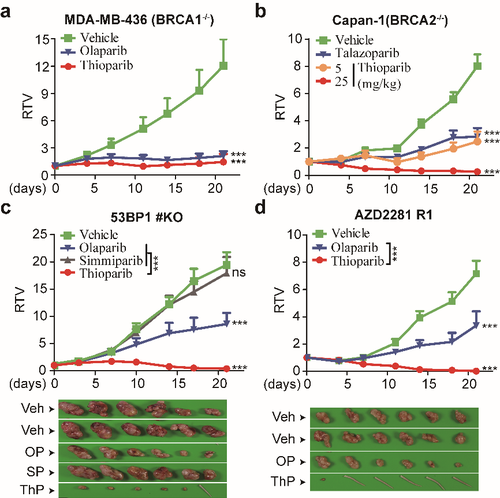
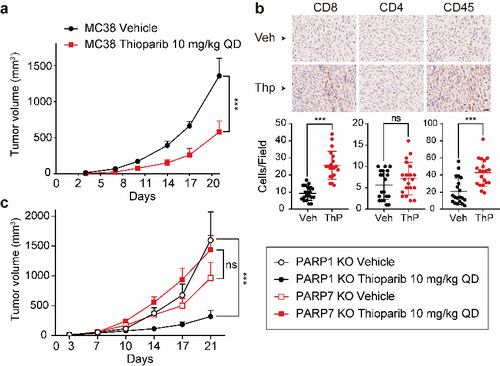
噻奥哌瑞显示突出的体内抗耐药作用。噻奥哌瑞强效抑制BRCA1缺陷乳腺癌MDA-MB-436(T/C:0.12;图2a)、对奥拉帕尼原发耐药的BRCA2缺陷胰腺癌Capan-1(T/C:0.03;图2b)移植瘤的生长。更为重要的是,噻奥哌瑞在53BP1缺失的耐药乳腺癌、奥拉帕尼获得性耐药的移植瘤模型中,同样显示显著的生长抑制作用(T/C:0.02;图2c和T/C:0.0;图2d)。在免疫完善的MC38小鼠皮下移植瘤模型中,噻奥哌瑞通过抑制PARP7、增加CD8+T细胞的浸润,产生抗肿瘤免疫作用(图3)。
图2噻奥哌瑞在免疫缺陷小鼠体内抗肿瘤(a)、抗耐药(b-d)作用。
图3噻奥哌瑞在免疫功能完善小鼠抑制PARP7、激活抗肿瘤免疫作用。
新一代PARP抑制剂噻奥哌瑞抑制PARP1、PARP7活性,诱导DNA损伤蓄积、干扰同源重组修复功能、激活抗肿瘤免疫,产生抗耐药作用,为奥拉帕尼耐药肿瘤的治疗探索提供了重要的支持。
上海药物研究所博士研究生王鲤敏、上海交通大学药学院联合培养博士研究生王平原(现中国海洋大学教授)和上海营养与健康研究所陈晓敏博士为该论文的共同第一作者。通讯作者为上海药物研究所贺金雪研究员、上海交通大学药学院张翱教授、上海药物研究所缪泽鸿研究员和上海营养与健康研究所郎靖瑜研究员。该研究获得了新药研究国家重点实验室、国家自然科学基金、中国科学院战略性先导科技专项和上海市科委启明星计划等的资助。