2023年3月9日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组在国际学术期刊Nature上在线发表题为“Nucleolar URB1 ensures 3'ETS rRNA removal to prevent exosome surveillance”的研究论文。该工作利用高分辨率活细胞显微成像技术,通过筛选200个核仁候选蛋白质发现12个在纤维中心/致密纤维组分(FC/DFC)外围富集的蛋白质,并命名该区域为致密纤维组分外侧区域(periphery of DFC,PDFC)。深入解析发现,位于PDFC的URB1(unhealthy ribosome protein 1)是一种具有非流动特征的核仁蛋白质,对维持PDFC的完整性、锚定pre-rRNA 3’端及保证其正确折叠和加工起到至关重要的作用。该工作揭示了核仁的超微精细结构,为解析核仁的功能和结构提供全新见解,为深入研究核仁蛋白质在pre-rRNA加工中的功能协调以及对核糖体生成和胚胎发育影响提供全新思路。
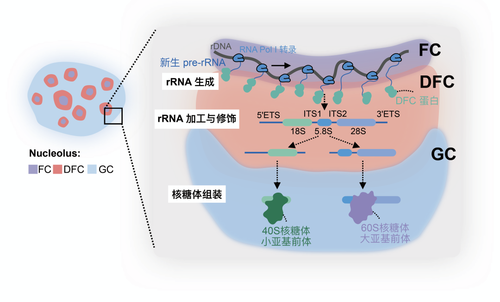
陈玲玲研究组长期致力于lncRNA代谢与功能的研究。前期通过non-poly(A)测序(Yang et al.,Genome Biol 2011)发现一类新型lncRNA家族,它们来自内含子,两端以snoRNA结尾,研究人员将其命名为sno-lncRNA(Yin et al.,Mol Cell 2012)。SLERT是其中一个sno-lncRNA,完全定位在细胞核仁(Xing et al.,Cell 2017)。核仁是细胞核内一个复杂且高度动态变化的无膜亚结构,是细胞核内核糖体RNA(ribosomal RNA,rRNA)的加工厂。它在调节rRNA的转录、加工以及核糖体亚基组装中发挥着重要作用。核仁在形态上由内而外可以分为三层结构:多个纤维中心(Fibrillar Center,FC)和致密纤维组分(Dense Fibrillar Component,DFC)形成球状结构镶嵌在颗粒区(Granular Component,GC)内。之前的研究表明SLERT直接结合核仁蛋白DDX21并调控其形成的环状结构的大小进而促进RNA聚合酶I转录(Xing et al.,Cell 2017;Wu et al.,Science 2021)。RNA聚合酶I转录复合物聚集在FC区域边缘对核糖体DNA(rDNA)进行转录;rRNA前体(pre-rRNA)加工蛋白质在DFC区域参与调控rRNA前体的定向转运和核仁DFC环簇状结构的组装(Yao et al.,Mol Cell 2019)。这些在FC/DFC单元产生的rRNA占细胞内总RNA的约85%,因此在FC/DFC中rRNA成熟的过程是一个受到精密调控的过程。加工修饰完成的pre-rRNA进入GC区域参与核糖体亚基的组装。核仁的重要功能毋庸置疑,但大多数核仁蛋白质的精确定位及其如何参与pre-rRNA高效有序加工等基础生物学问题尚不清楚。
图1核糖体RNA和核糖体亚基在核仁内高效有序加工和组装
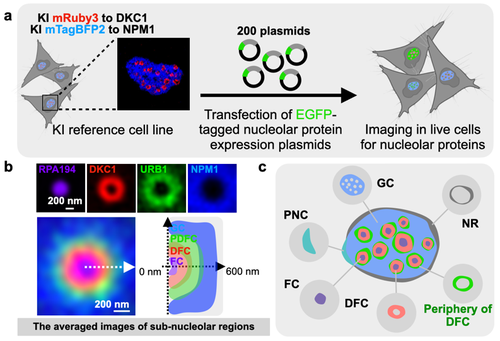
研究人员利用CRISPR/Cas9技术构建了DFC/GC双色荧光蛋白质标记的参考细胞系,在此细胞系内对200个核仁候选蛋白质进行了高分辨率的活细胞成像,并筛选到140个定位在细胞核仁不同亚结构区域的蛋白质。对这140个核仁蛋白质的深入研究发现,12个蛋白质定位于DFC外部,形成厚度约为200 nm的球壳状新结构,被命名为PDFC。研究人员进一步利用光学超分辨显微成像系统性地完善了核仁的精细亚结构分析,为更好地认识核仁组织结构和工作机制提供了重要基础。
图2高分辨率活细胞筛选发现核仁全新特征区域-PDFC
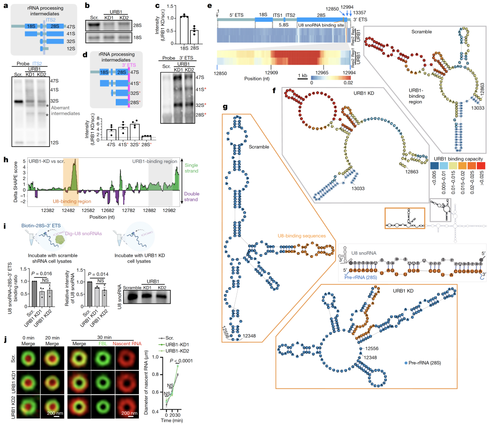
研究人员发现PDFC关键蛋白质URB1具有分子量大,流动性慢的特征,对于维持PDFC的结构和功能至关重要。此外它还参与调控pre-rRNA 3’末端ETS区域(External transcribed spacer,ETS)折叠和加工。其在PDFC的定位参与了3’ETS的锚定、折叠与去除。URB1缺失导致3’ETS折叠异常,U8 snoRNA与pre-rRNA的结合受阻,从而导致3’ETS的加工异常。
图3 PDFC关键蛋白质URB1调控pre-rRNA 3’末端的折叠和加工a-d:Northern Blot结果表明URB1蛋白质调控pre-rRNA加工;e:iCLIP实验结果证明URB1结合在pre-rRNA 3’末端;f-h:SHAPE-MaP实验发现URB1参与调控pre-rRNA 3’末端折叠及与U8 snoRNA的结合;i:体外结合实验表明URB1蛋白质缺失导致U8 snoRNA与pre-rRNA的结合受阻;j:新生RNA标记实验证明URB1蛋白质缺失将导致pre-rRNA无法有序运输
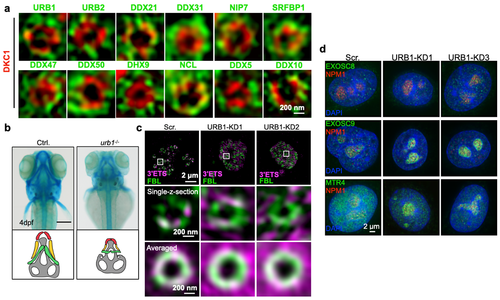
这些异常的pre-rRNA中间产物在核仁中大量累积,进而激活RNA稳态监控系统(RNA Exosome)在核仁发挥活性,引发异常pre-rRNA的降解,导致成熟的28S rRNA减少,无法维持细胞内核糖体的稳态和蛋白质合成,因此造成斑马鱼和小鼠的早期发育缺陷,甚至死亡。
图4 PDFC蛋白质URB1调控pre-rRNA生成及胚胎发育。a.12个PDFC蛋白质的超高分辨率细胞成像b.Urb1敲除导致斑马鱼颅骨发育异常c.URB1缺失导致3’ETS异常保留的pre-rRNA在核仁内累积d.URB1缺失激活RNA稳态监控系统在核仁发挥活性
此项研究工作利用超高分辨率生物成像、单分子RNA成像、RNA二级结构解析以及动物模型等多种研究手段,全面揭示了核仁精细结构与pre-rRNA的加工相互协同,共同维持核仁内微环境稳定,为认识核仁功能提供了全新的见解。此外,该研究证明了URB1这类非流动性蛋白质在核仁液-液相分离环境中的关键组织作用,为深入理解三维pre-rRNA加工机制、核仁组装形成和功能提供了新的思路。
图5核仁蛋白质协同核仁精细结构与pre-rRNA加工的新机制
分子细胞卓越中心陈玲玲研究组博士研究生单琳和许光(现为麻省理工学院博士后)为该论文的共同第一作者,分子细胞卓越中心研究员、新基石研究员陈玲玲为该论文通讯作者。特别感谢复旦大学生物医学研究院/复旦大学附属儿童医院杨力研究员、中国科学院分子细胞科学卓越创新中心李劲松院士、清华大学俞立教授和北京协和医院医学科学研究中心黄超兰教授的大力帮助。该工作同时得到分子细胞科学卓越创新中心细胞分析技术平台、斑马鱼技术平台、分子生物学技术平台和浙江大学良渚实验室的支持,以及来自中科院、基金委、科技部、上海市科委等部门的经费资助。陈玲玲研究员致谢科学探索奖的支持。