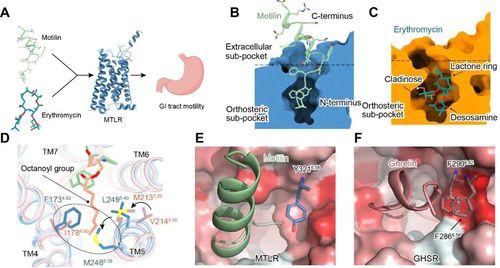
胃动素(motilin)是由胃肠道细胞分泌的多肽激素之一,其特异性激活表达在内分泌器官、胃肠道等特定组织的胃动素受体(motilin receptor,MTLR)(图1A)。Motilin-MTLR信号通路对于维持移行性运动复合波(migrating motor complex,MMC)至关重要,而MMC反映了消化道系统在进食间期的生理状态以及营养吸收状态。该信号通路对于调控人体胃肠道运动,激素分泌以及进食/饥饿信号至关重要。
MTLR与胃饥饿素受体(ghrelin receptor,GHSR)具有高度的序列同源性,跨膜区更是高达86%。多肽激素胃动素与胃饥饿素(ghrelin)也具有36%的序列同源性,然而二者对各自受体表现出高度的结合特异性。这些序列的高度同源性如何实现多肽的靶标识别特异性?这是该类家族受体函需解决的重要科学问题之一。
除受内源多肽胃动素的激活外,MTLR可以被传统大环内酯类抗生素红霉素等激活。红霉素的抗菌靶点为细菌核糖体RNA。红霉素通过抑制细菌蛋白质的合成,发挥抗菌活性,但往往伴随腹泻、恶心、呕吐等胃肠道副作用。在上世纪80年代,科学界发现红霉素能够活化MTLR从而引起胃肠道反应,这也是抗生素被首次鉴定为GPCR的配体类型(图1A)。抗生素如何识别MTLR?该识别模式与motilin对受体的识别有何异同?对这些问题的回答对理解红霉素的胃肠道副作用,指导更低毒副作用的抗菌药物发现具有重要的指导意义。
2023年3月15日,临港实验室蒋轶团队联合中国科学院上海药物研究所徐华强团队,在Science Advances杂志发表了题为“Structural basis for motilin and erythromycin recognition by motilin receptor”的研究论文。
研究人员利用冷冻电镜技术首次解析了MTLR分别与内源性配体motilin和大环内酯类抗生素红霉素,以及偶联下游Gq蛋白复合物的三维结构,揭示了MTLR独特的多肽识别机制,阐述了MTLR和GHSR的多肽选择性机制。研究也首次揭示了抗生素——红霉素新颖的MTLR结合模式,并剖析了红霉素识别MTLR和细菌核糖体RNA的异同。
Motilin的氨基端插入配体的正构结合口袋,它决定了motilin的高亲和力。Motilin的羧基端形成了α-Helix,它主要与胞外的延伸口袋结合,并参与调节配体的识别和受体的脱敏(图1B)。进一步研究表明,ghrelin辛酰化修饰基团与MTLR疏水口袋大侧链残基存在空间位阻(图1D),以及MTLR在配体口袋的上方相对GHSR缺失的疏水通道(图1E,F)等可能介导motilin和ghrelin对各自靶受体的结合特异性。这些结果加深了科学界对内源性多肽识别MTLR选择性和受体激活机制的理解。
图1 MTLR的配体多样性和多肽选择性。A-C.胃动素受体的生理功能与MTLR配体口袋剖面图。D.饥饿素辛酰化基团与MTLR输水口袋的空间位阻。E-F.MTLR和GHSR的多肽通道。
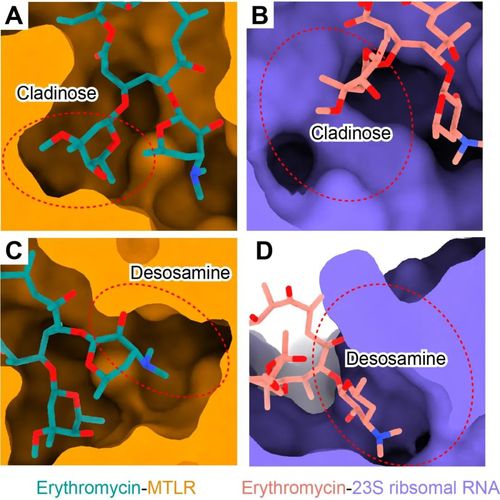
该研究也首次揭示了抗生素分子——大环内酯类抗生素红霉素识别MTLR的分子机制。红霉素与motilin的氨基末端五肽在空间结构上部分重叠,其支糖环和脱氧糖胺环向下插入配体结合口袋,而内酯环结合于口袋上方胞外段(图1C)。比较红霉素与细菌核糖体的结合模式发现,红霉素的支糖环在核糖体的结合口袋中存在较大的空腔,而其脱氧糖胺环被紧密包裹。与之相反,红霉素的脱氧糖胺环在MTLR的配体结合口袋附近存在较大的空腔(图2)。这些结构信息为设计和开发高效和低胃肠道毒性的大环内酯类抗生素提供了新思路。
图2红霉素识别机制的差异性
本研究中的冷冻电镜数据由中国科学院上海高峰电镜中心和中国科学院上海药物研究所冷冻电镜平台收集。上海药物所博士生游宠昭、上海科技大学与上海药物所联合培养博士生章雨牧,以及上海药物所徐有伟副研究员为该论文的共同第一作者,蒋轶和徐华强研究员为共同通讯作者,上海药物所为第一完成单位。该工作获得了包括国家自然科学基金委、科技部重大专项,以及上海市市级科技重大专项等基金的资助。