2023年5月24日,国际学术期刊Science Advances在线发表了中国科学院上海营养与健康研究所邵振研究组题为“Charting a high-resolution roadmap for regeneration of pancreaticβcells by in vivo transdifferentiation from adult acinar cells”的合作研究论文。该成果揭示了一系列影响体内诱导成年小鼠腺泡细胞转分化实现胰岛β细胞再生的关键因子。
成年哺乳动物再生功能性细胞的能力非常有限,但令人振奋的是,体内转分化通过谱系重编程过程,诱导其他完全分化的细胞转分化,实现了功能性细胞的再生。以胰腺β细胞再生为例,已有研究报道,通过Mafa,Pdx1,和Ngn3(M3因子)这三个转录因子的慢病毒载体,实现了将成年小鼠的胰腺腺泡细胞体内诱导重编程为胰岛β细胞的转分化过程。通过体内诱导转分化再生的β细胞可以产生并分泌胰岛素,并且在小鼠体内不会引起排异反应,非常有望用于治愈糖尿病。腺泡细胞是胰腺中最丰富的细胞类型,占比高达99%,可以为β细胞再生提供理想的来源,而且胰腺微环境还能促进再生的β细胞成熟并形成胰岛样结构。对于诱导腺泡细胞再生β细胞这一体内转分化过程,目前的了解还停留在表层,细胞的命运发生了怎样的变化,有哪些因子在这个过程中起关键作用,还需要更深入的研究和解读。
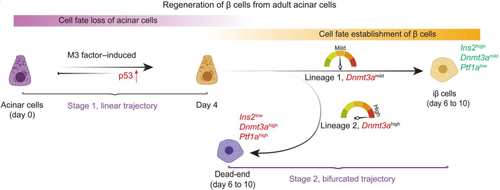
邵振研究组与同济大学李维达研究组合作开展了对体内诱导成年小鼠腺泡细胞转分化为β细胞的单细胞转录组研究。首先,从宏观上看,转分化过程的细胞轨迹在早期阶段是单线的,被定义为阶段一;而在后期阶段是二分叉的,被定义为阶段二,且分叉点处延伸出的两条细胞命运路线分别对应重编程成功的诱导型β细胞和重编程失败的细胞。分别对这两个阶段的进一步研究发现,p53在阶段一通过调控细胞周期阻滞发挥重编程阻碍因子的作用,Dnmt3a在阶段二高表达导致细胞走向重编程失败的命运终点。而且,敲除p53或者降低Dnmt3a的表达水平都会提高β细胞再生的效率。总而言之,该研究描绘了体内诱导成年小鼠腺泡细胞转分化为胰岛β细胞的高分辨率转录图谱,发现了一系列重要调控因子,为优化哺乳动物体内再生提供了详细的分子蓝图。
同济大学博士刘刚、中科院上海营养与健康研究所博士生李雅娜以及美国宾州州立大学博士生李木山为该论文的共同第一作者。同济大学李维达教授、上海营养与健康研究所邵振研究员以及同济大学张振宁副教授为该论文的共同通讯作者。该项工作得到了国家重点研发计划以及上海市科学技术委员会重点项目经费资助。
图注:该图描述了M3因子体内诱导腺泡细胞向β细胞转分化过程中阻碍因子的工作机制设想。p53在阶段一短暂地上调,作为重编程阻碍因子发挥作用。而Dnmt3a在阶段二的异质性表达可能导致细胞命运发生改变:Dnmt3a的适度表达使细胞重编程成功,最终转化为β细胞;Dnmt3a的高表达导致细胞重编程失败,细胞最终呈现的分子特征包括:Ptf1a(腺泡细胞标记基因)、Dnmt3a高表达,Ins2(β细胞标记基因)低表达。