代谢型谷氨酸受体(Metabotropic glutamate receptor,mGlu)是人体内最重要的神经递质受体之一,通过与兴奋性神经递质——谷氨酸结合,调控神经信号的传递。其生理功能涉及学习、认知、记忆及情绪调控等,是阿尔兹海默症、帕金森病、焦虑症等重大神经系统疾病潜在的治疗靶点。
mGlu属于C类G蛋白偶联受体(G protein-coupled receptor,GPCR)家族,不同于其它类型GPCR,C类GPCR必须形成二聚体,才能发挥功能。近年来,越来越多的研究表明,mGlu除了形成同源二聚体以外,不同亚型之间还可组装成多种类型的异源二聚体。这些异源二聚体发挥的功能不同于同源二聚体,使该家族受体的功能调控机制进一步复杂化和多样化。然而,mGlu异源二聚体的二聚化模式、功能调控模式以及信号转导机制还不清楚,极大地制约了这类重要受体的生理、病理机制研究和药物研发。
中国科学院上海药物研究所吴蓓丽课题组和赵强课题组长期致力于mGlu家族的结构与功能研究,取得了一系列突破性进展。2021年,该团队在Nature“背靠背”发表两篇研究论文(点击查看),报道了多种人源mGlu受体处于多种功能状态的三维结构,并开展深入的功能研究,首次全面阐释mGlu同源二聚体从非活化到完全活化的精细构象变化,揭示其复杂的信号转导机制。
此次,该联合团队与上海药物所许叶春课题组合作,针对两种不同类型mGlu异源二聚体开展系统的结构和功能研究,解析了12个不同功能状态的冷冻电镜结构,包括mGlu2–mGlu3异源二聚体分别处于非激活、非激活中间态、激活中间态和完全激活态(与Gi蛋白结合)的三维结构,以及mGlu2–mGlu4异源二聚体处于激活中间态和完全激活态的结构,揭示这些异源二聚体非对称激活的分子机制,并发现新型功能调控位点,极大地促进了对于mGlu异源二聚体信号转导和功能调控机制的深入理解,为靶向mGlu的药物开发提供了新思路。相关研究论文“Structural insights into dimerization and activation of the mGlu2–mGlu3 and mGlu2–mGlu4 heterodimers”于2023年6月8日在Cell Research在线发表。
研究人员通过在实验体系中添加不同类型的拮抗性配体(包括正构配体和变构配体),解析了6个mGlu2-mGlu3的非激活态结构。发现该异源二聚体与不同配体结合时,mGlu2亚基和mGlu3亚基通过不同方式组装成二聚体。研究团队进一步利用二硫键交联实验,证实了这些不同二聚化模式的存在。这些研究结果表明,当mGlu2-mGlu3异源二聚体处于非激活态时,受体构象具有多样性与动态性。
以往研究表明,除了非激活态和完全激活态以外,mGlu二聚体还具有多种中间态,使其功能调控进一步精细化。然而,捕捉这些中间状态的信息十分困难,相关分子机制一直未被阐明。为了全面揭示mGlu的信号转导机制,研究团队首次解析了mGlu2-mGlu3异源二聚体处于非激活中间态的三维结构,发现其中mGlu3亚基的胞外结构域处于激活的闭合状态,而mGlu2亚基的胞外结构域则处于非激活的开放状态。利用分子动力学模拟和突变体功能研究,发现mGlu3亚基的胞外结构域具备更强的闭合能力,且该亚基胞外结构域的闭合足以使整个异源二聚体激活,而mGlu2亚基发挥的作用则较弱。这些发现表明,mGlu3亚基的胞外结构域在mGlu2-mGlu3的激活过程中起主导作用。
这项研究的另外一项重要成果是揭示了mGlu异源二聚体非对称信号转导机制。以往人们发现,每一种mGlu异源二聚体会特异性地选择其中一个特定亚基与G蛋白结合,但相关选择性机制不清楚。研究人员通过结构和功能研究,发现mGlu2-mGlu3利用mGlu2亚基与G蛋白结合,负责信号转导,而mGlu2-mGlu4则利用mGlu4亚基进行信号转导。进一步分析两种异源二聚体的完全激活态结构,并进行突变体细胞信号转导实验,发现各亚基非激活态构象的稳定性以及该亚基与G蛋白的结合能力,是决定其在信号转导中发挥作用的关键因素,即亚基的非激活态构象越不稳定,与G蛋白的结合能力越强,在信号转导中发挥的作用越重要。这是首次阐明mGlu异源二聚体非对称信号转导的精细分子基础,对于深入理解其功能调控机制具有重要意义。
此外,研究人员还首次在mGlu二聚体作用界面上发现了一个全新的药物作用位点。在mGlu2-mGlu4与Gi蛋白结合的复合物结构中,mGlu4的变构激动剂ADX88178位于两个亚基跨膜结构域的作用界面上,通过与两个亚基形成紧密的相互作用,稳定该异源二聚体的非对称二聚化模式,从而促进其激活。与之不同的是,mGlu2的变构激动剂JNJ-40411813的结合位点位于mGlu2亚基的跨膜结构域的结合口袋中,通过稳定该亚基激活态构象的方式激活受体。这些不同的作用模式充分体现了mGlu变构配体作用机制的多样性,为精准靶向mGlu的药物研发提供了全新的思路。
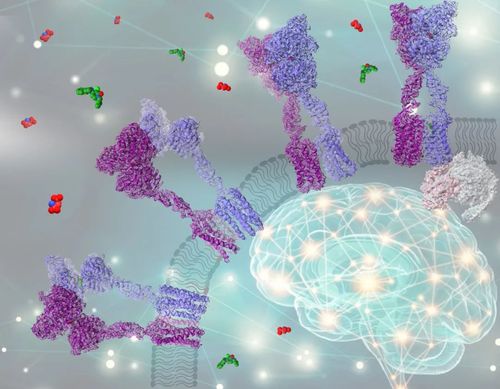
图.代谢型谷氨酸受体异源二聚体结构示意图。代谢型谷氨酸受体在调节神经信号传递中发挥关键作用,是重大神经系统疾病的潜在药物靶点。图中处于不同功能状态的四个mGlu2-mGlu3异源二聚体结构用飘带图表示,其中蓝色飘带为mGlu2亚基,紫色飘带为mGlu3亚基。从左下到右上分别为非激活态、非激活中间态、激活中间态以及完全激活态。完全激活态中的G蛋白的三个亚基分别用粉色、浅蓝色和浅灰色表示。谷氨酸和小分子变构配体JNJ-40411813分别用红色小球和绿色小球表示。
上海药物所博士生王昕苇和徐拓、邵强研究员以及上海科技大学博士生王沐和封椰是研究论文的共同第一作者。上海药物所吴蓓丽研究员、赵强研究员和林淑玲副研究员为研究论文的共同通讯作者。该项目主要合作者还包括上海药物所许叶春研究员和韩硕副研究员。研究获得国家自然科学基金委员会、国家科技部、中国科学院和上海市科学技术委员会等部门的经费支持。