8月13日,国际学术期刊Nature Communications在线发表了中国科学院上海免疫与感染研究所晁彦杰研究组的研究论文:RNA interactome of hypervirulent Klebsiella pneumoniae reveals a small RNA inhibitor of capsular mucoviscosity and virulence。该研究聚焦于高毒力高耐药超级细菌的致病机制,利用自主研发的微生物活细胞RNA-RNA互作组研究技术(iRIL-seq),揭示了高毒力肺炎克雷伯菌的非编码RNA调控网络图谱,发现非编码小RNA通过靶向一个新型毒力因子从而有效抑制超级细菌感染与疾病发生。
高毒力肺炎克雷伯菌可在健康人体中引起严重感染,导致肺炎、肝脓肿、脑膜炎、脓毒症等多种疾病,病情发展迅速、传播快、病死率高,已在全球16个不同国家报告发现,具有潜在大流行的风险,被世界卫生组织列为急需控制的优先病原体。这种新型超级肺炎细菌致病机制不明,缺乏明确的蛋白质毒力因子,研究发现关键致病因子是细菌表面的高黏性荚膜多糖,帮助该菌逃逸宿主免疫系统的识别与清除,实现多组织器官的入侵与复制。因此,了解荚膜多糖的合成如何调控,以及高黏性如何产生,是阐明高毒力肺炎克雷伯菌致病机理的关键。非编码小RNA是原核病原微生物中数量最多的一类转录后调控因子,通过与靶标mRNA进行直接互作配对,调节靶标mRNA的翻译或降解过程,在细菌毒力、抗生素耐药、营养代谢、压力应激、生物膜合成、群体感应等许多生物学过程中发挥重要的作用。该研究利用一项近期自主开发的微生物活细胞RNA-RNA互作组学研究技术iRIL-seq (Nat. Commun,2023,14:8106),全面建立了高毒力肺炎克雷伯菌中的RNA-RNA互作网络,发现了多个非编码小RNA调控荚膜多糖合成相关基因表达与荚膜黏性的直接证据。
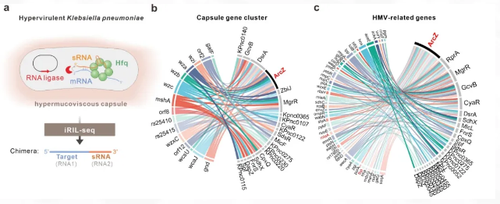
图1. RNA-RNA互作组揭示高毒力肺炎克雷伯菌中荚膜多糖基因的RNA调控网络
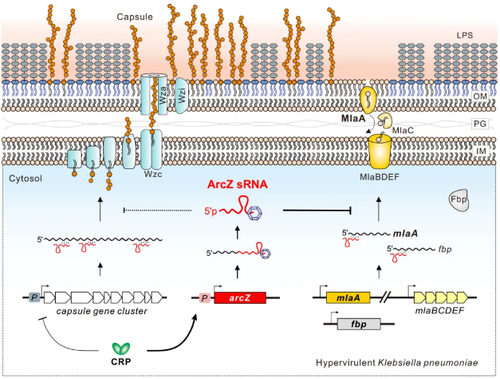
基于RNA-RNA互作组数据,研究人员筛选测试了20多个非编码小RNA,发现ArcZ对荚膜黏性具有最强烈的抑制作用,能够显著抑制高毒力肺炎克雷伯菌感染小鼠致病。ArcZ的抑制作用高度保守,不受菌株基因型与荚膜型的影响,在高毒力且高耐药临床菌株中仍有显著效果,表明ArcZ是一种具有临床治疗潜力的强效RNA抑制剂。研究进一步发现了激活ArcZ转录表达的碳源代谢信号与相关转录因子CRP;鉴定了ArcZ调控的下游靶标基因mlaA和fbp,分别编码了外膜磷脂转运蛋白MlaA和果糖磷酸酶Fbp,证明ArcZ利用RNA-RNA碱基互作机制在转录后水平抑制mlaA与fbpmRNA的翻译表达,揭示了一个全新的CRP-ArcZ-MlaA高黏性荚膜调控通路。
图2. 高毒力肺炎克雷伯菌非编码小RNA ArcZ抑制毒力荚膜黏性的分子机制
外膜磷脂转运蛋白MlaA不直接参与荚膜多糖的合成,该研究进一步阐明了MlaA调控高黏性的分子机制。通过对mlaA基因进行敲除、基因组回补、蛋白关键位点突变等深入分析,意外发现MlaA蛋白及其介导的磷脂转运活性对荚膜高黏性和致病性都至关重要,是一个尚未被报道的新型毒力因子。缺失MlaA不仅导致高毒力肺炎克雷伯菌荚膜黏性显著降低,而且造成细菌毒力大幅下降,丧失感染小鼠的能力。因此,该研究不仅揭示了一个高毒力超级细菌感染致病的新型毒力机制,而且发现了靶向抑制该毒力机制的非编码RNA分子,为开发新型抗感染药物和超级细菌疫苗提供了新的思路与方向。
中国科学院上海免疫与感染研究所晁彦杰研究员为该论文唯一通讯作者;晁彦杰研究组助理研究员吴可菁、博士研究生林星宇、硕士研究生陆雨洁为论文共同第一作者。该工作得到了北京大学第三医院沈宁、郑佳佳的帮助;受到了国家重点研发计划、中国科学院B类先导计划、国家自然科学基金等科研项目的经费支持。
原文链接:https://doi.org/10.1038/s41467-024-51213-z
研究组简介
微生物RNA系统生物学研究组(负责人:晁彦杰研究员)以人体重要病原菌和共生菌为研究对象(如肠道沙门菌、肺炎克雷伯菌等),利用独特的高通量测序技术和功能基因组实验方法,鉴定新型的非编码小RNA、RNA结合蛋白并解析其功能与机制,加深对微生物感染致病、耐药持留、宿主互作和共生机制的认识。课题组主持承担多项国家级人才与科研项目,在Nature, Mol Cell, Nature Comm, EMBO J, EMBO Mol Medicine, Trends in Microbiol, Emerging Microb & Infections等国际期刊发表30多篇高水平论文,引用超过7000次,欢迎有志青年加入团队。