中国科学院上海营养与健康研究所李于研究组发现丝氨酸/苏氨酸蛋白磷酸酶PPP6C在小鼠和人类代谢功能障碍相关脂肪性肝炎(MASH)中具有重要调节作用。该研究首次揭示,肝细胞中的PPP6C通过响应并介导成纤维细胞生长因子21(FGF21)/βKlotho信号通路,显著改善纤维化与MASH的疾病进程。这一发现为深入探索FGF21在临床治疗MASH中的分子机制,以及FGF21激动剂作为新兴疗法的潜力,提供了坚实的理论依据和研究基础。2月10日,相关研究成果在线发表于肝病学领域权威期刊Journal of Hepatology。
代谢功能障碍相关脂肪肝炎目前已成为全球最常见的慢性肝脏疾病,显著增加肝硬化和肝细胞癌的发病风险。FGF21激动剂在治疗MASH方面的潜力巨大,随着临床研究的深入,其有望成为治疗代谢功能障碍相关脂肪肝炎的首选药物。尽管FGF21类似物在多项临床试验中表现出良好的耐受性和显著疗效,但FGF21改善和治疗MASH分子机制仍不明确。
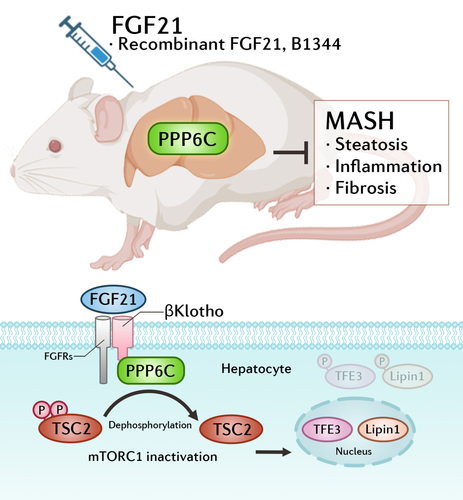
为阐明FGF21是否通过自分泌的方式调控MASH进展,研究团队首先构建了FGF21的辅受体βKlotho肝细胞特异性敲除小鼠模型。通过构建饮食诱导MASH模型,并结合FGF21重组蛋白与FGF21类似物B1344皮下注射干预,研究发现肝细胞βKlotho敲除显著阻断FGF21对MASH的改善作用,证实FGF21通过肝细胞表面FGFR/βKlotho受体复合物介导的自分泌信号通路改善MASH进程。
为深入解析FGF21调控MASH的分子机制,研究人员采用蛋白质相互作用质谱筛选技术,首次鉴定出蛋白磷酸酶PPP6C能够直接与βKlotho结合,并能响应FGF21信号。研究发现肝细胞PPP6C缺失不仅显著加剧MASH进展,而且阻断了FGF21对MASH的治疗效果,提示PPP6C在FGF21信号通路中发挥重要作用。
在分子机制层面,FGF21/βKlotho信号通路通过激活PPP6C磷酸酶活性,促进其与结节性硬化复合物2(TSC2)形成复合物,进而抑制TSC2在Ser939/Thr1462位点的磷酸化,最终下调mTORC1信号通路活性。这一调控过程促使转录因子TFE3和Lipin1发生核转位,最终实现抑制脂质合成相关基因表达、促进脂肪酸氧化基因转录的双重调控。
值得注意的是,在临床患者和小鼠MASH肝脏组织中PPP6C表达水平显著下降,表明PPP6C及其介导的TSC2去磷酸化修饰可能在小鼠及人的MASH发病过程中均发挥重要作用。
本研究发现FGF21通过肝细胞FGFR/βKlotho介导的自分泌信号通路显著增强PPP6C活性。FGF21的药理学作用主要通过βKlotho与PPP6C的直接相互作用,以及PPP6C介导的肝细胞TSC2去磷酸化来有效抑制MASH病理进展。这一重要发现提示,通过靶向PPP6C活性,可能为肝纤维化和MASH的治疗提供新的策略和潜在治疗靶点。
图:FGF21激活PPP6C治疗肝纤维化与代谢功能障碍相关脂肪性肝炎
FGF21通过肝细胞βKlotho-PPP6C相互作用,以自分泌方式改善MASH。具体而言,FGF21/βKlotho激活PPP6C磷酸酶活性,招募并介导TSC2在Ser939/Thr1462位点的去磷酸化,抑制mTORC1活性并促进转录因子TFE3/Lipin1核转位。该发现为FGF21激动剂作为新兴的治疗方案奠定了重要理论基础,通过靶向调控PPP6C活性可能为MASH的临床治疗提供新策略。
文章链接:https://www.journal-of-hepatology.eu/article/S0168-8278(25)00079-0/fulltext