北京时间4月19日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)王红艳研究组联合上海大学、复旦大学和上海交通大学在国际学术期刊Immunity在线发表最新研究成果:“25-Hydroxycholesterol regulates lysosome AMP kinase activation and metabolic reprogramming to educate immunosuppressive macrophages”。该研究发现了抑炎巨噬细胞活化的关键胆固醇代谢酶CH25H及代谢物25-HC,为靶向巨噬细胞的肿瘤免疫治疗提供了代谢新靶点,也为胆固醇代谢重编程调控天然免疫提供了新见解。

巨噬细胞响应病原微生物感染,能分泌促炎细胞因子及干扰素等清除病原,也能响应肿瘤微环境或细胞因子IL-4/IL-13的刺激,表达抑炎细胞因子和精氨酸酶(Arg1)以消耗微环境中的精氨酸,阻断T细胞增殖和杀伤肿瘤的功能。胆固醇代谢物是细胞膜和细胞器膜的重要成分,能调控细胞增殖、迁移和炎症等功能,胆固醇紊乱则与多种疾病相关。实验室前期合作发现7-脱氢胆固醇积累能促进一型干扰素产生,这与胆固醇抑制干扰素的功能截然相反(Xiao et al., Immunity 2020)。胆固醇氧化生成25-羟基胆固醇(25-Hydroxycholesterol, 25-HC);进而25-HC氧化产生7a,25-羟胆固醇。25-HC和7a,25-羟胆固醇在自身免疫性疾病系统性红斑狼疮(SLE)病人外周血中升高。7a,25-羟胆固醇通过结合和激活巨噬细胞表面的G蛋白偶联受体EBI2, 抑制多种趋化因子和炎症因子的表达,减轻SLE发病(Zhang et al., Adv Sci 2023)。然而,胆固醇代谢如何调控肿瘤相关巨噬细胞(Tumor-Associated Macrophages, TAMs)的免疫抑制功能及分子机制尚不清楚。
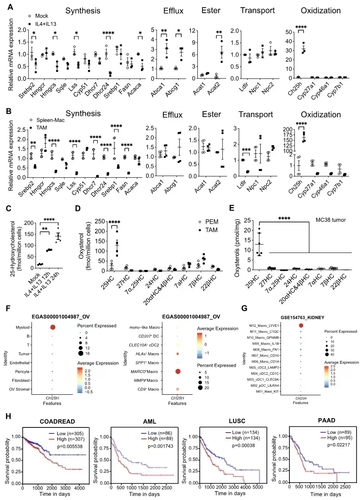
TAMs高表达CH25H并累积25-HC
研究团队利用3种免疫抑制型巨噬细胞,包括细胞因子IL-4和IL-13刺激的M2型巨噬细胞、肝癌细胞系Hepa1-6条件性培养基孵育的巨噬细胞、实体肿瘤组织中分选的TAMs,筛选胆固醇代谢酶的表达水平,发现胆固醇25-羟化酶(cholesterol-25-hydroxylase, CH25H)均被诱导高表达。前人研究已经证实感染促进CH25H高表达,将胆固醇氧化为25-HC,以阻断病毒通过膜融合的方式入侵宿主细胞。该研究发现M2型巨噬细胞、TAMs及肿瘤组织中氧化固醇25-HC的水平升高。scRNA-seq分析已发表的数据,发现多种实体肿瘤组织中MARCO+TAMs或LYVE1+TAMs高表达CH25H,且与肿瘤病人预后负相关。
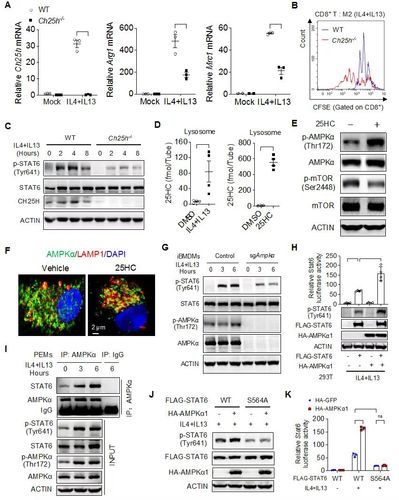
溶酶体累积的25-HC通过AMPKa-STAT6增强了TAM免疫抑制功能
进一步研究发现肿瘤微环境中的乳酸能诱导Ch25h,以及细胞因子IL-4/IL-13通过转录因子STAT6调控Ch25h转录。累积的25-HC在巨噬细胞溶酶体聚集,并与胆固醇竞争结合溶酶体定位的信号蛋白GPR155,以抑制mTORC1活化。通过增强AMPKa活化,使得转录因子STAT6第564位丝氨酸磷酸化以增强STAT6的转录活性,最终促进巨噬细胞产生更多Arg1和抑炎因子。在巨噬细胞中敲除Ch25h能逆转TAM的免疫抑制功能,阻断多种皮下肿瘤的发展,并伴有肿瘤组织中增强的T细胞浸润和活化及高表达免疫检查点PD-1,因此anti-PD1单抗联用能进一步增强抗肿瘤效果。
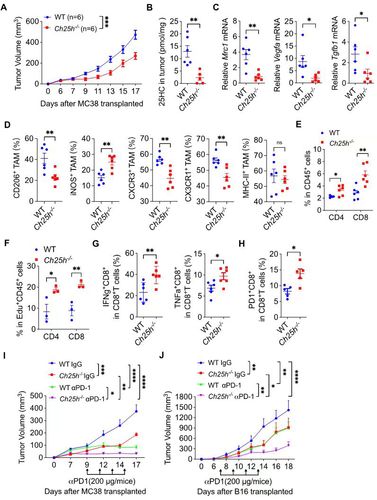
CH25H的缺失限制了肿瘤生长并增强了anti-PD1的抗肿瘤效果
综上所述,靶向胆固醇氧化酶CH25H促进了“冷肿瘤”向“热肿瘤”转变,并能联合免疫检查点以提高肿瘤免疫的疗效。由于氧化固醇含量少、不稳定,难以定量和定位。通过合作,该团队提出了氧化固醇和胆固醇定位在溶酶体,二者相互制衡以调控巨噬细胞命运的概念,同时将胆固醇氧化酶CH25H和氧化固醇25-HC从感染领域拓展到肿瘤免疫治疗领域。

